Nomenklatura chemii nieorganicznej
W historii ludzkości Nomenklatura chemii nieorganicznej odegrał fundamentalną rolę w rozwoju i ewolucji społeczeństwa. Od samego początku Nomenklatura chemii nieorganicznej przyciąga uwagę i wyobraźnię ludzi, inspirując wszelkiego rodzaju doświadczenia, emocje i refleksje. Niezależnie od tego, czy ze względu na swój wpływ na kulturę popularną, wpływ na dziedzinę nauki czy znaczenie w polityce światowej, Nomenklatura chemii nieorganicznej pozostawił niezatarty ślad w historii. W tym artykule zbadamy rolę, jaką Nomenklatura chemii nieorganicznej odegrał na przestrzeni czasu i jak ukształtował bieg ludzkości w różnych aspektach.
Nomenklatura chemii nieorganicznej – dział nomenklatury chemicznej dotyczący chemii nieorganicznej.
Wysiłki w celu opracowania spójnego systemu nazewnictwa związków nieorganicznych podejmowane były od lat 40. XX wieku. Wraz z rozwojem chemii nieorganicznej i pojawiającymi się tendencjami do ujednolicenia nazewnictwa związków organicznych i nieorganicznych zmieniały się zalecenia dotyczące nazewnictwa systematycznego i akceptowanego nazewnictwa tradycyjnego oraz nazw pośrednich. Wytyczne te opracowywane są od 2001 roku przez Division of Chemical Nomenclature and Structure Representation Międzynarodowej Unii Chemii Czystej i Stosowanej, a wcześniej przez IUPAC Commission on Nomenclature of Inorganic Chemistry. Najnowsza publikacja (stan na rok 2016), tzw. Red Book, z zaleceniami dotyczącymi m.in. nazewnictwa rekomendowanego, akceptowanego i niewskazanego, pochodzi z roku 2005. Zalecenia te obejmują symbole i nazewnictwo pierwiastków chemicznych oraz związków nieorganicznych. IUPAC proponuje trzy ogólne systemy nomenklaturowe oraz dwa uzupełniające dla kwasów tlenowych i ich pochodnych, np. anionów, soli i estrów. Ponadto odrębne rozdziały poświęcone są związkom koordynacyjnym i metaloorganicznym oraz ciałom stałym[1].
System nazewnictwa nieorganicznego opracowywany jest przez IUPAC w języku angielskim, a następnie dostosowywany do innych języków przez odpowiednie organizacje współpracujące z IUPAC. W Polsce jest to Podkomisja Nomenklatury Nieorganicznej Polskiego Towarzystwa Chemicznego, której ostatnie zalecenia zostały opublikowane w roku 1998 i były możliwie wiernym tłumaczeniem tzw. Red Book I z 1990 roku[2]. W 2021 roku PTChem opublikował roboczą wersję tłumaczenia niektórych rozdziałów zaleceń IUPAC z 2005 roku[3].
Zarówno IUPAC, jak i PTChem zalecają stosowanie nomenklatury systematycznej[1][2], jednak dla wybranych kwasów tlenowych i ich pochodnych o ugruntowanym nazewnictwie akceptowane są także nazwy tradycyjne[4][5][6].
Wzór chemiczny
Wzory chemiczne służą do symbolicznego zapisu składu pierwiastkowego lub budowy chemicznej danej substancji. W chemii nieorganicznej IUPAC wyróżnia trzy podstawowe typy wzorów chemicznych[7]:
- wzór empiryczny, w którym wymienia się pierwiastki wchodzące w skład cząsteczki w kolejności alfabetycznej, np. HO
4PRb
2 – wodorofosforan rubidu. Wyjątkiem są symbole C i H, wymieniane zwykle jako pierwsze w związkach zawierających węgiel; zob. zapis Hilla. Wzór ten nie wnosi żadnych informacji o budowie związku i jest stosowany zazwyczaj w celach katalogowych - wzór sumaryczny, w którym uwzględnia się elementy strukturalne cząsteczki, np. Rb
2HPO
4 – wodorofosforan rubidu; Hg
2Cl
2 – chlorek rtęci(I) - wzór strukturalny oddający budowę cząsteczki w sposób częściowy (wzory liniowe, półstrukturalne, np. ClHgHgCl) lub pełny (wzory strukturalne i przestrzenne), np.
Można zastosować również wzór półempiryczny, będący formą pośrednią pomiędzy wzorem empirycznym a sumarycznym, np. dla dziesięciowodnego boraksu[8]:
- wzór empiryczny: Na
2B
4O
17H
20 - wzór półempiryczny: Na
2B
4O
7·10H
2O - wzór sumaryczny: Na
2B
4O
5(OH)
2·8H
2O, tj. ośmiowodna sól disodowa anionu B
4O
5(OH)2−
2
W zapisie proponowanym przez IUPAC pomiędzy poszczególnymi składnikami cząsteczki, znakami i liczbami nie umieszcza się spacji, np. Na
2SO
4·10H
2O.
Kolejność symboli pierwiastków we wzorze sumarycznym

- Elektroujemność
O kolejności symboli pierwiastków we wzorze decyduje w pierwszym rzędzie ich przybliżona elektroujemność[7]. W związkach nieorganicznych wyróżnia się zazwyczaj składnik elektrododatni (np. metal) i elektroujemny (np. niemetal lub reszta kwasowa). W pierwszej kolejności we wzorze podaje się składnik elektrododatni, a następnie składnik elektroujemny, np.
Dla uniknięcia wątpliwości, IUPAC zdefiniował sekwencję pierwszeństwa pierwiastków pod względem elektroujemności[7]. Są one uszeregowane generalnie grupami i okresami układu okresowego, poczynając od fluoru, a kończąc na radonie[9]:
- F → fluorowce → tlenowce → H → azotowce → węglowce → borowce → cynkowce → miedziowce → niklowce → kobaltowce → żelazowce → manganowce → chromowce → wanadowce → tytanowce → skandowce → lantanowce → aktynowce → berylowce → litowce → helowce → Rn.
W przypadku połączeń dwóch pierwiastków pierwszeństwo w zapisie ma pierwiastek znajdujący się dalej w ww. szeregu, tj.:
- w grupie o niższym numerze, np. K (1 grupa) ma pierwszeństwo przed Ca (2 grupa)
- w okresie o wyższym numerze, np. K (4 okres) ma pierwszeństwo przed Na (3 okres)
Dla gazów szlachetnych przyjmuje się pierwszeństwo przed litowcami. Wodór umiejscowiony jest pomiędzy azotowcami a tlenowcami. Tlen ma pierwszeństwo przed wszystkimi fluorowcami[9]. Przykłady:
- NI
3: azot (N) poprzedza jod (I) - BF
3: bor (B) poprzedza fluor (F) - NH
3: azot (N) poprzedza wodór (H) - H
2S: wodór (H) poprzedza siarkę (S)
- Porządek alfanumeryczny
Drugim kryterium kolejności zapisu symboli pierwiastków we wzorze jest porządek alfanumeryczny, np. AlK(SO
4)
2 (Al < K). Symbole jednoliterowe poprzedzają dwuliterowe (np. B < Be), a grupy pierwiastków sortuje się według symbolu pierwszego pierwiastka (np. NI
3 < PCl
3)[7].
Centra koordynacyjne, np. reszty kwasowe, traktuje się jako całość i zapisuje w postaci grupy, np. SO
4, PO
4 itp. Ugrupowanie takie można ująć w nawiasy kwadratowe, np. Ca; taki sposób zapisu jest wymagany dla związków kompleksowych, np. K
4.
Ze względu na specyfikę języka polskiego, wzory odczytuje się w odwrotnej kolejności, tzn. najpierw składnik elektroujemny, potem elektrododatni:
- NaI – jodek sodu
- NH
4Cl – chlorek amonu - CaSO
4 – siarczan wapnia
Kwasy tlenowe
Dla kwasów tlenowych zastosować można dwa systemy zapisu wzoru sumarycznego:
- tradycyjny, w którym podaje się kolejno
- „kwasowe” (związane z tlenem, ulegające wymianie) atomy wodoru
- symbol atomu centralnego
- atomy wodoru nieulegające wymianie (związane bezpośrednio z atomem centralnym)
- atomy tlenu
- koordynacyjny, w którym podaje się kolejno
- symbol atomu centralnego
- ligandy (w kolejności alfabetycznej)
- Przykład
- kwas fosfonowy:
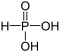
kwas fosfonowy - zapis tradycyjny: H
2PHO
3 - zapis koordynacyjny:
- zapis tradycyjny: H
Sole złożone i addukty
Sole złożone, addukty (w tym hydraty) itp. zapisuje się, wymieniając w porządku alfabetycznym poszczególne składniki i rozdzielając je kropką w połowie wysokości znaków[10], np.:
- BF
3·2MeOH - Al
2(SO
4)
3·K
2SO
4·24H
2O
Alternatywnie wzory takie można zapisać w sposób[11]:
- koordynacyjny:
- półempiryczny: AlK(SO
4)
2·12H
2O
Nazewnictwo systematyczne
Stosowanie nomenklatury systematycznej zaleca się szczególnie dla nowych związków. IUPAC proponuje różne systemy nomenklaturowe, a wybór właściwego zależy od budowy związku i potrzeb autora, np. czy istotny jest skład stechiometryczny, czy wskazanie budowy jonu centralnego[1]:
- nomenklatura konstytucyjna (stechiometryczna; ang. compositional (stoichiometric) nomenclature)
- nomenklatura podstawnikowa (ang. substitutive nomenclature)
- nomenklatura addytywna (ang. additive nomenclature)
oraz dla kwasów i ich pochodnych:
- nomenklatura wodorowa (ang. hydrogen nomenclature)
- nomenklatura wymiany funkcyjnej (ang. functional replacement nomenclature)
Nomenklatura konstytucyjna (stechiometryczna)

W systemie tym przedstawia się jedynie skład atomowy cząsteczki poprzez podanie liczby atomów lub centrów koordynacyjnych (np. reszt kwasowych)[12]. Odwrotnie niż we wzorze chemicznym, w nazwie podaje się najpierw składnik bardziej elektroujemny, np. tritlenek diżelaza, Fe
2O
3, trioksydosiarczan disodu, Na
2SO
3 lub tris(heksacyjanidożelazian) tetrażelaza, Fe
4
3. Liczbę atomów lub jonów określa się za pomocą przedrostków zwielokrotniających: di-, tri-, tetra-, penta- itd. W celu uniknięcia niejednoznaczności dla jonów złożonych stosuje się przedrostki: bis-, tris-, tetrakis-, pentakis- itd., np.:
- difosforan diwapnia, Ca
2P
2O
7 (zawiera jeden anion difosforanowy) - bis(fosforan) triwapnia, Ca
3(PO
4)
2 (zawiera dwa aniony fosforanowe)
Przedrostek „mono-” podaje się jedynie w szczególnych przypadkach dla podkreślenia stechiometrii[13].
Stechiometrię cząsteczki można wyrazić, podając (zamiast lub obok przedrostków zwielokrotniających):
- stopień utlenienia za pomocą liczb rzymskich (dodatnich, ujemnych oraz 0), czyli tzw. liczb Stocka, np.:
- trioksydosiarczan(IV) sodu, Na
2SO
3 - heksacyjanidożelazian(II) żelaza(III), Fe
4
3
- trioksydosiarczan(IV) sodu, Na
- ładunek jonu za pomocą liczb arabskich, np.:
- trioksydosiarczan(2−) sodu, Na
2SO
3 - heksacyjanidożelazian(4−) żelaza(3+), Fe
4
3
- trioksydosiarczan(2−) sodu, Na
Przykładowo, dla związku o wzorze K
2S poprawne są następujące nazwy[14]:
- siarczek potasu
- siarczek dipotasu
- siarczek(2−) potasu
- siarczek(2−) dipotasu
Dla układów złożonych grupuje się składniki elektrododatnie i elektroujemne i w ramach grupy wymienia się je w kolejności alfabetycznej, np.:
- azotan wodorotlenek magnezu, Mg(NO
3)(OH) - bis(siarczan) glinu potasu, AlK(SO
4)
2
Składniki elektrododatnie
Stosowanie końcówek awy/owy dla wskazania stopnia utlenienia pierwiastka elektrododatniego (np. kationu) nie jest akceptowane przez IUPAC[15]. Jego nazwę podaje się w formie rzeczownika w dopełniaczu, a nie przymiotnika, np.:
- FeCl
2: dichlorek żelaza lub chlorek żelaza(II), nie „chlorek żelazawy” - FeCl
3: trichlorek żelaza lub chlorek żelaza(III), nie „chlorek żelazowy”
Składniki elektroujemne
Końcówki nazw składników elektroujemnych (np. anionów) mogą być następujące:
- „ek” lub „ik” – dla układów jedno- lub homopoliatomowych (np. chlorek, fosforek, węglik; disiarczek, triazotek)
- „an” – dla układów heteropoliatomowych (np. siarczan, azotan, węglan)
- „yn” – dla układów heteropoliatomowych, w nazwach tradycyjnych (np. siarczyn, azotyn, chloryn)
Nazwy anionów homopoliatomowych tworzy się, dodając do nazwy anionu jednoatomowego przedrostek zwielokrotniający. IUPAC dopuszcza stosowanie kilku nazw tradycyjnych[12]:
| Wzór | Nazwa systematyczna | Akceptowana nazwa tradycyjna |
|---|---|---|
| O− 2 lub O•− 2 |
ditlenek(1−) lub ditlenek(•1−) | ponadtlenek |
| O2− 2 |
ditlenek(2−) | nadtlenek |
| O− 3 |
tritlenek(1−) | ozonek |
| C2− 2 |
diwęglik(2−) | acetylenek |
| N− 3 |
triazotek(1−) | azydek |
Nomenklatura podstawnikowa

3PO
3
Nomenklatura podstawnikowa jest systemem zbliżonym do nomenklatury związków organicznych. Podstawą tworzenia nazwy w tym systemie jest wodorek macierzysty, tj. wodorek pierwiastka stanowiącego atom centralny[16]. Nazwa wodorku powinna być nazwą systematyczną, np. boran (BH
3), metan (CH
4)[a], silan (SiH
4), azan (NH
3), fosfan (PH
3), oksydan (H
2O), sulfan (H
2S), selan (H
2Se)[17]. Standardowe wodorki zawierają następującą liczbę atomów wodoru:
Dla związków o innej wartościowości atomu centralnego wartościowość tę podaje się, stosując symbol λ wraz z liczbą wiązań w indeksie górnym, np. λ4 wskazuje na cztery wiązania. Wiązania wielokrotne wskazuje się końcówkami -en i -yn/-in, podobnie jak dla związków organicznych.
- Przykłady
- PH: λ1-fosfan
- PH
3: fosfan - PH
5: λ5-fosfan - H
2PPH
2: difosfan - HP=PH: difosfen
Podobnie jak w chemii organicznej, podstawniki wskazywać można albo przedrostkami (amino-, hydroksy-, chloro- itp.), albo przyrostkami (-amina, -ol, -tiol itp.), np.
- Si(OH)
4: tetrahydroksysilan lub silanotetraol - SiH
3NH
2: silanoamina lub aminosilan - SF
2: difluorosulfan - SF
6: heksafluoro-λ6-sulfan
Nomenklatura addytywna

3PO
3 i soli trisodowej
W systemie tym wymienia się alfabetycznie kolejne ligandy atomu centralnego (w razie potrzeby stosując przedrostki zwielokrotniające, di-, tri- itp.), kończąc nazwą tego atomu[18]. Dla pochodnych (soli, estrów, anionów) nazwę atomu zastępuje się nazwą anionu, dodając w razie potrzeby ładunek jonu, np.:
- H
3SO+
4: trihydroksydooksydosiarka(1+) - H
2SO
4: dihydroksydodioksydosiarka - HSO−
4: hydroksydotrioksydosiarczan(1−) - CuSO
4: tetraoksydosiarczan(2−) miedzi(2+)
Jest to system przewidziany do tworzenia systematycznych nazw kwasów tlenowych i ich pochodnych[19].
Częściej spotykane przedrostki zwielokrotniające i ligandy podane są poniżej w sekcjach „Przedrostki zwielokrotniające” i „Ligandy”.
Nomenklatura wodorowa

3PO
4 i NaH
2PO
4
Jest to system alternatywny, który można używać dla związków zawierających wodór, np. kwasów, niektórych anionów i wodorosoli. Nazwę rozpoczyna się od słowa „wodoro” (w razie potrzeby poprzedzonego przedrostkiem zwielokrotniającym), po którym w nawiasie okrągłym, bez spacji, podaje się nazwę anionu, po której, także bez spacji, należy w razie potrzeby podać ładunek jonu, np. HMnO
4 = wodoro(tetraoksydomanganian), H
2PO+
3 = diwodoro(trioksydofosforan)(1+).
- Przykład 1
- Wzór: H
3PO
4 lub - Nazwa tradycyjna (półsystematyczna), akceptowana przez IUPAC: kwas fosforowy
- Nazwy systematyczne:
- nomenklatura podstawnikowa: trihydroksy-λ5-fosfanon (jako pochodna λ5-fosfanu, PH
5, gdzie λ5 – liczba wiązań atomu centralnego; „trihydroksy” – trzy grupy OH, przyrostek „-on” – ligand „=O”) - nomenklatura addytywna: trihydroksydooksydofosfor („trihydroksydo” – trzy ligandy −OH, „oksydo” – ligand „=O”, „fosfor” – atom centralny)
- nomenklatura wodorowa: triwodoro(tetraoksydofosforan)
- nomenklatura podstawnikowa: trihydroksy-λ5-fosfanon (jako pochodna λ5-fosfanu, PH
- Przykład 2
- Wzór: NaHSO
3 - Nazwa tradycyjna (półsystematyczna), akceptowana przez IUPAC: wodorosiarczyn sodu
- Nazwy systematyczne:
- nomenklatura addytywna: hydroksydodioksydosiarczan sodu
- nomenklatura wodorowa: wodoro(trioksydosiarczan) sodu
Nomenklatura wymiany funkcyjnej

Dla pochodnych kwasów, w których atom tlenu lub grupa hydroksylowa zostały zastąpione innym atomem lub grupą, można zastosować nomenklaturę wymiany funkcyjnej, w której wymiana wskazana jest przez przedrostki (p) i wrostki (w), np.
- OH → NH
2: amid(o) (p, w) - O → OO: peroksy (p), perokso (w)
- O → S: tio (p, w)
- O → Cl: chloro (p), chloryd(o) (w)
Przykłady nazw podane są w tabeli poniżej, w sekcji „Pochodne kwasów tlenowych”.
Zmiany w nazwach systematycznych IUPAC od roku 2005
W nazewnictwie addytywnym od roku 2005 stosuje się nazwy ligandów zakończone przyrostkiem -ido/-ydo, np. -oksydo (ligand „=O”), -hydroksydo (ligand „−OH”) zamiast wcześniej zalecanych -okso, -hydrokso. W nazewnictwie addytywnym kwasów zaniechano też stosowania słowa „kwas” (jako wskazującego pewne właściwości chemiczne) na rzecz używania nazwy oddającej wyłącznie strukturę związku.
- Przykład
- Wzór: H
2SO
4 - Nazwa tradycyjna: kwas siarkowy
- Wybrane nazwy systematyczne do 2005:
- kwas tetraoksosiarkowy
- kwas tetraoksosiarkowy(VI)
- tetraoksosiarczan wodoru
- tetraoksosiarczan(VI) wodoru
- Nazwa addytywna po 2005:
- dihydroksydodioksydosiarka
| Wzór | Nazwa systematyczna (addytywna) | Nazwa tradycyjna | Nazwa według systemu Stocka | Dawne nazwy systematyczne[i] |
|---|---|---|---|---|
| HNO 2 |
hydroksydooksydoazot | kwas azotawy | kwas azotowy(III) | kwas dioksoazotowy, dioksoazotan wodoru |
| HNO 3 |
hydroksydodioksydoazot | kwas azotowy | kwas azotowy(V) | kwas trioksoazotowy, trioksoazotan wodoru |
| H 2SO 3 |
dihydroksydooksydosiarka | kwas siarkawy | kwas siarkowy(IV) | kwas trioksosiarkowy, trioksosiarczan diwodoru |
| H 2SO 4 |
dihydroksydodioksydosiarka | kwas siarkowy | kwas siarkowy(VI) | kwas tetraoksosiarkowy, tetraoksosiarczan diwodoru |
| H 3PO 3[ii] |
trihydroksydofosfor[iii] | kwas fosforawy[iii] | kwas fosforowy(III)[iii] | kwas trioksofosforowy[iii], trioksofosforan triwodoru[iii] |
| hydrydodihydroksydooksydofosfor[iv] | kwas fosfonowy[iv] | kwas fosfonowy(III)[iv] | kwas hydrydotrioksofosforowy[iv], hydrydotrioksofosforan diwodoru[iv] | |
| H 3PO 4 |
trihydroksydooksydofosfor | kwas fosforowy | kwas fosforowy(V) | kwas tetraoksofosforowy, tetraoksofosforan triwodoru |
| HClO | hydroksydochlor | kwas podchlorawy | kwas chlorowy(I) | kwas oksochlorowy, oksochloran wodoru |
| HClO 2 |
hydroksydooksydochlor | kwas chlorawy | kwas chlorowy(III) | kwas dioksochlorowy, dioksochloran wodoru |
| HClO 3 |
hydroksydodioksydochlor | kwas chlorowy | kwas chlorowy(V) | kwas trioksochlorowy, trioksochloran wodoru |
| HClO 4 |
hydroksydotrioksydochlor | kwas nadchlorowy | kwas chlorowy(VII) | kwas tetraoksochlorowy, tetraoksochloran wodoru |
- ↑ Nazwę można uzupełnić opcjonalnie o stopień utlenienia (np. trioksosiarczan(IV) diwodoru) lub ładunek jonu (np. trioksosiarczan(2−) diwodoru), jeśli uważa się to za pomocne.
- ↑ Nazwa H
3PO
3 zależy od jego formy tautomerycznej. - ↑ a b c d e Dla formy z trzema wiązaniami P−OH.
- ↑ a b c d e Dla formy z dwoma wiązaniami P−OH i układem wiązań H−P=O.
| Wzór | Nazwa systematyczna (addytywna) | Nazwa tradycyjna | Nazwa według systemu Stocka |
|---|---|---|---|
| NaNO 2 |
dioksydoazotan(1−) sodu | azotyn sodu | azotan(III) sodu |
| Ca(NO 3) 2 |
trioksydoazotan(1−) wapnia | azotan wapnia | azotan(V) wapnia |
| NaHSO 3 |
hydroksydodioksydosiarczan(1−) sodu | wodorosiarczyn sodu | wodorosiarczan(IV) sodu |
| Fe 2(SO 4) 3 |
tetraoksydosiarczan(2−) żelaza(3−) | siarczan żelaza(III) | siarczan(VI) żelaza(III) |
| K 3PO 3 |
trioksydofosforan(3−) potasu | fosforyn potasu | fosforan(III) potasu |
| Ca(H 2PO 4) 2 |
dihydroksydodioksydofosforan(1−) wapnia | diwodorofosforan wapnia | diwodorofosforan(V) wapnia |
| Ca(ClO) 2 |
chlorydooksygenian(1−) wapnia[i] lub oksydochloran(1−) wapnia[i] |
podchloryn wapnia | chloran(I) wapnia |
- ↑ a b Ze względu na ustaloną kolejność pierwiastków (wszystkie fluorowce przed tlenem, zob. sekwencję), nazwy systematyczne podhalogeninów mają kolejność odwrotną od tradycyjnej, stąd chlorydooksygenian(1−) wapnia. Ponieważ jednak w pozostałych kwasach tlenowych halogenowców i ich solach o kolejności w nazwie decyduje atom centralny, np. oksydochloran(5−) wapnia dla Ca(ClO
3)
2, dopuszcza się stosowanie analogicznych nazw dla podhalogeninów, np. oksydochloran(1−) wapnia[20].
Nazewnictwo związków addycyjnych
Związki typu adduktów mają nazwy systematyczne składające się z nazw poszczególnych komponentów rozdzielonych pauzami, po których w nawiasie podaje się zawartość poszczególnych komponentów w związku. O kolejności komponentów decyduje liczba cząsteczek w związku, a następnie porządek alfabetyczny. Wyjątkiem jest woda, umieszczana zawsze na końcu nazwy. Nazwy komponentów można tworzyć, stosując nazewnictwo konstytucyjne, podstawnikowe lub addytywne. Dla związków addycyjnych zawierających wodę akceptowane są nazwy zawierające słowo „hydrat” („wodzian”)[21].
- Przykłady
- CaCl
2·8NH
3: chlorek wapnia—amoniak (1/8) - Na
2SO
4·10H
2O:- siarczan sodu—woda (1/10)
- dekahydrat siarczanu sodu
Przedrostki
Przedrostki geometryczne i strukturalne

IUPAC: tri-μ-oksydo-tris(hydroksydooksydofosfor)
W systematycznej nomenklaturze chemicznej stosuje się szereg przedrostków określających cechy geometryczne i strukturalne, np. cis, trans, cyklo, katena, sym oraz litery greckie, np. μ, λ, Δ. Przedrostki te należy pisać kursywą (poza literami greckimi) i oddzielać od dalszej części nazwy łącznikiem, np. kwas cyklo-trifosforowy. Do przedrostków tego typu częściej spotykanych w chemii nieorganicznej należą[22]:
- κ: wskazuje atom donorowy ligandu
- λ: wraz z liczbą w indeksie górnym λn wskazuje liczbę wiązań atomu centralnego
- μ: wskazuje, że grupa tak oznaczona łączy dwa centra koordynacyjne
- cyklo: wskazuje strukturę pierścieniową
- katena: wskazuje strukturę łańcuchową
Przedrostki zwielokrotniające
Podkomisja Nomenklatury Nieorganicznej PTChem zaleca stosowanie międzynarodowych przedrostków zwielokrotniających (greckich lub łacińskich)[2]. Według niektórych autorów, ze względu na ugruntowane nazwy tradycyjne, dopuszcza się stosowanie przedrostków polskich[23] [24].
Wybrane przedrostki zwielokrotniające[23] [25]:
- 1 – mono[i]
- 2 – di (dwu)/bis[ii]
- 3 – tri (trój)/tris[ii]
- 4 – tetra (cztero)/tetrakis[ii]
- 5 – penta (pięcio)/pentakis[ii]
- 6 – heksa (sześcio)/…[ii]
- 7 – hepta (siedmio)
- 8 – okta (ośmio)
- 9 – nona (dziewięcio)
- 10 – deka (dziesięcio)
- 11 – undeka (jedenasto)
- 12 – dodeka (dwunasto)
- 13 – trideka (trzynasto)
- 20 – ikoza (dwudziesto)
- 21 – henikoza (dwudziestojedno)
- 22 – dokoza (dwudziestodwu)
- …
- 30 – triakonta (trzydziesto)
- 35 – pentatriakonta (trzydziestopięcio)
- 40 – tetrakonta (czterdziesto)
- 100 – hekta (stu)
- 1/2 – hemi/semi (pół)
- 3/2 – seskwi (półtora)
- n – poli (wielo)
- ↑ Przedrostek „mono-” podaje się jedynie w szczególnych przypadkach dla podkreślenia stechiometrii (Red Book 2005 ↓, s. 70).
- ↑ a b c d e Przedrostki typu bis, tris itd. stosuje się dla uniknięcia niejednoznaczności dla jonów złożonych. Niewymienione wyższe przedrostki tego typu tworzy się przez dodanie „kis” do przedrostka podstawowego.
Ligandy
Nazwy wybranych ligandów częściej spotykanych w nazwach addytywnych i konstytucyjnych nieorganicznych związków chemicznych[2][26]:
- −H: hydrydo
- ≡N: nitrydo lub azanotriido
- =O: oksydo
- =S: sulfido lub sulfanodiido
- −F, −Cl, −Br, −I: fluorydo, chlorydo, bromido, jodydo[b]
- =NH: imido lub azanodiido lub wodoronitrato
- −NH
2: amido lub azanido lub diwodoronitrato - −OH: hydroksydo lub oksydanido
- −SH: sulfanido lub wodoro(sulfido)
- −OOH: dioksydanido lub wodoro(peroksydo)
Nazewnictwo niesystematyczne kwasów tlenowych i ich pochodnych
System Stocka
„Liczba Stocka” oznacza stopień utlenienia pierwiastka lub centrum koordynacyjnego zapisywaną w nazwie związku chemicznego bezpośrednio po danym składniku. Współczesny format zapisu to liczba rzymska w nawiasie okrągłym, bez spacji pomiędzy członem nazwy a nawiasem. IUPAC zdecydowanie zaleca stosowanie liczb Stocka dla wskazania wartościowości metalu w solach zamiast dawniej używanych końcówek -awy/-owy oraz przedrostków pod-/nad-.
W polskim systemie edukacyjnym zaleca się stosowanie systemu Stocka także dla kwasów tlenowych i ich pochodnych, np.:
- H
2SO
3: kwas siarkowy(IV) (tradyc. kwas siarkawy) - H
2SO
4: kwas siarkowy(VI) (tradyc. kwas siarkowy) - NaNO
2: azotan(III) sodu (tradyc. azotyn sodu) - NaNO
3: azotan(V) sodu (tradyc. azotan sodu)
Nazewnictwo to nie jest nazewnictwem systematycznym i nie jest wyszczególniane jako zalecane zarówno przez IUPAC, jak i Polskie Towarzystwo Chemiczne (PTChem)[1][2][30][31][32][33]. Nazewnictwo to pojawiło się jako „obowiązkowe” w wydanej w 1999 roku przez PTChem publikacji Nomenklatura związków chemicznych. Poradnik dla nauczycieli, a według jej autorów przedstawiała obowiązujące zasady nazewnictwa związków nieorganicznych i opierała się na wydanym rok wcześniej przez PTChem polskim tłumaczeniu Nomenklatury związków nieorganicznych[34], w którym jednak nazewnictwo tego typu nie zostało w żadnym miejscu wspomniane[2]. Stosowanie liczby Stocka zalecane jest natomiast w nazwach związków kompleksowych. Liczby Stocka należy też używać w nazwach tradycyjnych, które mogą być niejednoznaczne, np. MnO2−
4 – manganian(VI); MnO3−
4 – manganian(V).
Akceptowane nazwy tradycyjne
Dla szeregu związków (zwłaszcza kwasów i ich pochodnych) IUPAC akceptuje nazwy tradycyjne, które mają ugruntowaną pozycję w nazewnictwie. W nazwach tych struktura anionu i wartościowość lub stopień utlenienia atomu centralnego określane są za pomocą zrostków:
- Przedrostki
- „pod-” – niższa wartościowość/stopień utlenienia
- „nad-” – wyższa wartościowość/stopień utlenienia
- „meta-” – minimalna zawartość wody w anionie
- „orto-” – maksymalna zawartość wody w anionie. Dla związków, których nazwa jest jednoznaczna bez tego przedrostka, można go opuszczać (np. „kwas fosforowy” = „kwas ortofosforowy”)
- „piro-” – (niezalecane) anion powstały z kondensacji dwóch cząsteczek anionu typu „orto”; obecnie zamiast „piro-” IUPAC zaleca stosowanie przedrostka „di-”
- Przyrostki
- „-awy” – niższa wartościowość (dla kwasów)
- „-yn” lub „-in” – niższa wartościowość (dla pochodnych kwasów)
- „-owy” – wyższa wartościowość (dla kwasów)
- „-an” – wyższa wartościowość (dla pochodnych kwasów)
- Stosowanie końcówek -awy/-owy w celu wskazania stopnia utlenienia jest akceptowane przez IUPAC jedynie dla anionów kwasów, natomiast jest nieakceptowane dla kationów metali, dla których zaleca się podawanie liczb Stocka lub ładunku jonu, np. żelazo(II) lub żelazo(2+) (zamiast daw. „żelazawy”).
- Wrostki
- „-in-” lub „-yn-” – niższy stopień utlenienia
- „-on-” – wyższy stopień utlenienia
Wrostki z literą „n” wskazują na bezpośrednie połączenie atomu centralnego z atomem wodoru lub węgla. W zależności od nazwy kwasu zamiast wrostków stosuje się zastąpienie litery „r” literą „n” (kwas fosforowy/kwas fosfonowy) lub całkowicie zmienioną nazwę (kwas siarkowy/kwas sulfonowy). Atomy wodoru połączone z atomem centralnym we wzorze kwasu zapisywane są za atomem centralnym.
- Przykład
Przykładowe wzory i nazwy tlenowych kwasów fosforu. Występują tu następujące reguły korelacji między strukturą a nazwą:
- litera „r” w rdzeniu: wyłącznie wiązania P−O; litera „n” w rdzeniu: obecne wiązanie/wiązania P−H
- człon „-on-”: wyższy stopień utlenienia (V); człon „-in-”: niższy stopień utlenienia (III)
- końcówka „-owy”: wyższa wartościowość (5 wiązań); końcówka „-awy”: niższa wartościowość (3 wiązania)
 |
|
 |
|
 |
|
 |
|
- ↑ Dawna nazwa kwasu fosfinowego, „kwas podfosforawy”[31][35], nie odzwierciedla występowania wiązania P−H i nie jest wymieniana w nazwach akceptowanych przez IUPAC począwszy od roku 1970[32].
- ↑ Nazwa podstawnikowa; tautomer PH
3O nie jest kwasem tlenowym. - ↑ Dla związku PH
3 IUPAC zaleca nazwy „trihydrydofosfor”, „fosfan” lub „triwodorek fosforu” zamiast „fosfina”.
Zestawienie akceptowanych nazw tradycyjnych
Poniżej przedstawiono zestawienie wybranych tradycyjnych (półsystematycznych) nazw kwasów tlenowych, które są akceptowane przez IUPAC[4]. Akceptowane są także odpowiednie nazwy pochodnych (np. anionów, soli i estrów), które tworzy się, zastępując końcówki „-awy” i „-owy”, odpowiednio końcówkami „-yn/-in” i „-an”.
| Wzór | Nazwa tradycyjna | Wzór | Nazwa tradycyjna |
|---|---|---|---|
| Grupa 13 | Grupa 16 | ||
| H 3BO 3 |
kwas borowy (lub kwas ortoborowy) | H 2SO 3 |
kwas siarkawy |
| (HBO 2) n |
kwas metaborowy | HSHO 3 |
kwas sulfonowy |
| H 2BHO 2 |
kwas boronowy | H 2SO 4 |
kwas siarkowy |
| HBH 2O |
kwas borynowy | HSHO 2 |
kwas sulfinowy |
| Grupa 14 | H 2S 2O 7 |
kwas disiarkowy (daw. kwas pirosiarkowy) | |
| H 2CO 3 |
kwas węglowy | H 2S 2O 4 |
kwas ditionawy (daw. kwas podsiarkawy) |
| HOCN | kwas cyjanowy | H 2S 2O 6 |
kwas ditionowy (daw. kwas podsiarkowy) |
| HNCO | kwas izocyjanowy | H 2SeO 3 |
kwas selenawy |
| HCNO lub HONC | kwas piorunowy[i] | H 2SeO 4 |
kwas selenowy |
| H 4SiO 4 |
kwas krzemowy (lub kwas ortokrzemowy) | H 2TeO 3 |
kwas tellurawy |
| (H 2SiO 3) n |
kwas metakrzemowy | H 2TeO 4 |
kwas tellurowy |
| H 6Si 2O 7 |
kwas dikrzemowy i wyższe oligomery | H 6TeO 6 |
kwas ortotellurowy |
| Grupa 15 | Grupa 17 | ||
| HNO 2 |
kwas azotawy | HClO | kwas podchlorawy |
| HNO 3 |
kwas azotowy | HClO 2 |
kwas chlorawy |
| HPO 2 = |
hydroksyfosfanon[ii] | HClO 3 |
kwas chlorowy |
| PHO 2 |
λ5-fosfanodion[ii] | HClO 4 |
kwas nadchlorowy |
| HPH 2O |
kwas fosfinawy | HBrO | kwas podbromawy |
| HPH 2O 2 |
kwas fosfinowy (daw. kwas podfosforawy) | HBrO 2 |
kwas bromawy |
| H 2PHO 2 |
kwas fosfonawy | HBrO 3 |
kwas bromowy |
| H 3PO 3 |
kwas fosforawy (lub kwas ortofosforawy) | HBrO 4 |
kwas nadbromowy |
| H 2PHO 3 |
kwas fosfonowy | HIO | kwas podjodawy |
| H 3PO 4 |
kwas fosforowy (lub kwas ortofosforowy) | HIO 2 |
kwas jodawy |
| (HPO 3) n |
kwas metafosforowy | HIO 3 |
kwas jodowy |
| H 4P 2O 7 |
kwas difosforowy (daw. kwas pirofosforowy) | HIO 4 |
kwas nadjodowy |
| H 2P 2H 2O 5 |
kwas difosfonowy (daw. kwas pirofosforawy) | H 5IO 6 |
kwas ortonadjodowy |
| H 4P 2O 6 |
kwas poddifosforowy (daw. kwas podfosforowy) | ||
| H 3P 3O 9 |
kwas cyklo-trifosforowy (daw. kwas trimetafosforowy) | ||
| H 5P 3O 10 |
kwas katena-trifosforowy (lub kwas trifosforowy) | ||
| H 3AsO 3 |
kwas arsenawy | ||
| H 3AsO 4 |
kwas arsenowy | ||
| H 3SbO 3 |
kwas antymonawy | ||
| H 3SbO 4 |
kwas antymonowy | ||
- ↑ Nazwy „kwas piorunowy” i „izopiorunowy” bywały stosowane niejednolicie i zaleca się stosowanie nazw systematycznych: karbidohydroksydoazot (HONC = ) i (hydrydokarbonato)oksydoazot (HCNO = ). Oryginalna nazwa „kwas piorunowy” dotyczy kwasu o strukturze HCNO, który w rzeczywistości nie jest kwasem tlenowym, natomiast estry nazywane w chemii organicznej „piorunianami” mają strukturę RONC, co odpowiada kwasowi HONC.
- ↑ a b Nazwy podstawnikowe. Dla związków tych nie stosuje się zwykle słowa „kwas” w nazwie.
Pochodne kwasów tlenowych
IUPAC akceptuje nazwy tradycyjne także dla niektórych pochodnych kwasów tlenowych, w których atom tlenu zastąpiony został innym atomem[6]:
| Wzór | Nazwa tradycyjna | Nazwa wymiany funkcyjnej | Nazwa addytywna |
|---|---|---|---|
| HNO 4 = |
kwas nadtlenoazotowy | kwas nadtlenoazotowy | (dioksydanido)dioksydoazot |
| NO(OOH) | kwas nadtlenoazotawy | kwas nadtlenoazotawy | (dioksydanido)oksydoazot |
| NO 2NH 2 = |
nitramid | amid azotowy | amidodioksydoazot |
| H 3PO 5 = |
kwas nadtlenofosforowy | kwas fosforonadtlenowy | (dioksydanido)dihydroksydooksydofosfor |
| PCl 3O |
trichlorek fosforylu trichlorek tlenek fosforu |
trichlorek fosforylu | trichlorydooksydofosfor |
| H 4P 2O 8 = |
kwas nadtlenodifosforowy | kwas 2-nadtlenodifosforowy | μ-nadtleno-1κO,2κO'-bis(dihydroksydooksydofosfor) |
| H 2SO 5 = |
kwas nadtlenosiarkowy (kwas nadtlenomonosiarkowy) |
kwas siarkonadtlenowy | (dioksydanido)hydroksydodioksydosiarka |
| H 2S 2O 8 = |
kwas nadtlenodisiarkowy | kwas 2-nadtlenodisiarkowy | μ-nadtleno-1κO,2κO'-bis(hydroksydodioksydosiarka) |
| H 2S 2O 3 = |
kwas tiosiarkowy | O-kwas siarkotiowy | dihydroksydooksydosulfidosiarka |
| H 2S 2O 3 = |
kwas tiosiarkowy | S-kwas siarkotiowy | hydroksydodioksydosulfanidosiarka |
| H 2S 2O 2 = |
kwas tiosiarkawy | O-kwas siarkotiawy | dihydroksydosulfidosiarka |
| H 2S 2O 2 = |
kwas tiosiarkawy | S-kwas siarkotiawy | hydroksydooksydosulfanidosiarka |
| SO 2Cl 2 |
dichlorek sulfurylu dichlorek ditlenek siarki |
dichlorek sulfurylu | dichlorydodioksydosiarka |
| SOCl 2 |
dichlorek tionylu dichlorek tlenek siarki |
dichlorek siarkawy | dichlorydooksydosiarka |
| HSCN = | kwas tiocyjanowy | nitrydosulfanidowęgiel | |
| HNCS = | kwas izotiocyjanowy | imidosulfidowęgiel |
Uproszczone nazwy wodorowe
Dla wybranych wodorosoli i wodoroanionów IUPAC akceptuje uproszczoną nomenklaturę wodorową, w której pomija się nawiasy i ładunek anionu. Ze względu na możliwe niejednoznaczności IUPAC nie zaleca stosowania tego typu uproszczeń poza poniższą listą[5]:
| Wzór | Nazwa tradycyjna | Wzór | Nazwa tradycyjna |
|---|---|---|---|
| H 2BO− 3 |
diwodoroboran | H 2PO− 4 |
diwodorofosforan |
| HBO2− 3 |
wodoroboran | HPO2− 4 |
wodorofosforan |
| HCO− 3 |
wodorowęglan | HPHO− 3 |
wodorofosfonian |
| HSO− 4 |
wodorosiarczan | H 2PO− 3 |
diwodorofosforyn |
| HSO− 3 |
wodorosiarczyn | HPO2− 3 |
wodorofosforyn |
Praktyka nazewnictwa w publikacjach naukowych
Wybór systemu nazewnictwa zależy od preferencji użytkowników i organizacji, które mogą wymagać stosowania określonego systemu. W czasopismach naukowych autorzy publikacji używają zazwyczaj nazw tradycyjnych, także spoza zestawu nazw akceptowanych przez IUPAC.
| Związek | Nazwa tradycyjna | Nazwa addytywna IUPAC | Dawna nazwa IUPAC | Nazwa Stocka |
|---|---|---|---|---|
| H 2SO 3 |
sulfurous acid: 66[i]/27[ii]/328[iii] sulphurous acid: 12[i]/7[ii]/114[iii] |
dihydroxidooxidosulfur: 0[i][ii][iii] | trioxosulfuric acid: 0[i][ii][iii] hydrogen trioxosulfate: 0[i][ii][iii] |
sulfuric(IV) acid: 0[i][ii][iii] |
| Na 2SO 4 |
sodium sulfate: 4779[i]/1399[ii]/13842[iii] disodium sulfate: 6[i]/4[ii]/18[iii] |
disodium tetraoxidosulfate(2−): 0[i][ii][iii] | disodium tetraoxosulfate: 0[i][ii][iii] | sodium sulfate(VI): 0[i][ii][iii] disodium sulfate(VI): 0[i][ii][iii] |
| KMnO 4 |
potassium permanganate[iv]: 1173[i]/998[ii]/4716[iii] | potassium tetraoxidomanganate(1−): 0[i][ii][iii] | potassium tetraoxomanganate: 1[i][ii][iii] | potassium manganate(VII): 1[i][ii]/3[iii] |
| H 3PO 2 |
phosphinic acid: 995[i]/327[ii]/891[iii] phosphonous acid: 8[i]/3[ii]/26[iii] hypophosphorous acid[iv]: 63[i]/80[ii]/169[iii] |
dihydrydohydroxidooksydophosphorus: 0[i][ii][iii] hydrydodihydroxidophosphorus: 0[i][ii][iii] |
hydrogen dihydrydodioxophosphate(1−): 0[i][ii][iii] dihydrogen hydrydodioxophosphate(1−): 0[i][ii][iii] |
phosphonic(I) acid: 0[i][ii][iii] phosphoric(I) acid: 0[i][ii][iii] |
| P 2O4− 7 |
diphosphate: 24381[i]/5928[ii]/29122[iii] pyrophosphate[iv]: 4630[i]/4046[ii]/20351[iii] |
heptaoxidodiphosphate(4−): 0[i][ii][iii] | heptaoxodiphosphate(4−): 1[i][ii]/0[iii] | diphosphate(V): 4[i][ii]/14[iii] |
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad Baza danych Scopus (tytuły, streszczenia, słowa kluczowe).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad Baza danych Web of Science (tytuły, streszczenia, słowa kluczowe).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad Baza danych Scirus (tytuły, streszczenia, słowa kluczowe, pełny tekst).
- ↑ a b c Nazwa niezalecana przez IUPAC.
Uwagi
- ↑ Metan jest związkiem organicznym.
- ↑ Nazwy „fluorydo”, „chlorydo”, „bromido”, „jodydo” są tłumaczeniem angielskich nazw fluorido, chlorido, bromido, iodido, wprowadzonych w 2005 roku[27] i niemających jeszcze oficjalnych polskich odpowiedników zalecanych przez Polskie Towarzystwo Chemiczne. Są one jednak zgodne z nazwami zawartymi we wstępnym tłumaczeniu Nomenklatury chemii organicznej opublikowanym przez PTChem w 2016 roku[28]. Stosowanie dawniej zalecanych nazw „fluoro”, „chloro”, „bromo” i „jodo” należy obecnie ograniczyć do przedrostków w nomenklaturze wymiany funkcyjnej[29].
Przypisy
- ↑ a b c d Red Book 2005 ↓.
- ↑ a b c d e f Nomenklatura chemii nieorganicznej. Zalecenia 1990, Polskie Towarzystwo Chemiczne, 1998 (seria Wiadomości Chemiczne. Biblioteka), ISBN 83-229-1873-9.
- ↑ Materiały w trakcie opracowywania , Komisja Terminologii Chemicznej Polskiego Towarzystwa Chemicznego, listopad 2021 .
- ↑ a b Tabela IR 8.1. Red Book 2005 ↓, s. 127–132.
- ↑ a b IR-8.5 Abbreviated hydrogen names for certain anions. Red Book 2005 ↓, s. 137.
- ↑ a b Tabela IR-8.2. Red Book 2005 ↓, s. 139–140.
- ↑ a b c d IR-4 Formulae. Red Book 2005 ↓, s. 53–67.
- ↑ David Schubert, Boron Oxides, Boric Acid, and Borates. Section 2: Nomenclature, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, DOI: 10.1002/0471238961.0215181519130920.a01.pub3.
- ↑ a b Table VI. Red Book 2005 ↓, s. 260.
- ↑ IR-2.5.1 Dots. Red Book 2005 ↓, s. 27–28.
- ↑ Red Book 2005 ↓, s. 81.
- ↑ a b IR-5 Compositional Nomenclature, and Overview of Names of Ions and Radicals. Red Book 2005 ↓, s. 68–82.
- ↑ Red Book 2005 ↓, s. 70.
- ↑ Red Book 2005 ↓, s. 136.
- ↑ IR-5 Compositional Nomenclature, and Overview of Names of Ions and Radicals. Red Book 2005 ↓, s. 252, 256.
- ↑ IR-6 Parent Hydride Names and Substitutive Nomenclature. Red Book 2005 ↓, s. 81–110.
- ↑ Table IR-6.1 Parent names of mononuclear hydrides. Red Book 2005 ↓, s. 85.
- ↑ IR-7 Additive Nomenclature. Red Book 2005 ↓, s. 111–141.
- ↑ Red Book 2005 ↓, s. 12.
- ↑ Red Book 2005 ↓, s. 336 (przypis f).
- ↑ IR-5.5 Names of (formal) addition compounds. Red Book 2005 ↓, s. 80–81.
- ↑ Table V. Red Book 2005 ↓, s. 259.
- ↑ a b L. Pawłowski, H. Wasąg, M.R. Dudzińska, Ćwiczenia rachunkowe z chemii, Lublin: Politechnika Lubelska, Wydział Inżynierii Środowiska, 2008, s. 6–7.
- ↑ Władysław Walkowiak, Chemia nieorganiczna. 2. Nomenklatura, ePortal Wydziału Chemicznego Politechniki Wrocławskiej .
- ↑ Table IV. Red Book 2005 ↓, s. 258.
- ↑ Table IX. Red Book 2005 ↓, s. 280–336.
- ↑ Red Book 2005 ↓, s. 10–11.
- ↑ Henri A. Favre, Warren H. Powell, Nomenklatura związków organicznych. Rekomendacje IUPAC i nazwy preferowane 2013, Komisja Terminologii Chemicznej Polskiego Towarzystwa Chemicznego (tłum.), wyd. 1, Narodowy Komitet Międzynarodowej Unii Chemii Czystej i Stosowanej, , s. 92.
- ↑ Red Book 2005 ↓, s. 138.
- ↑ W.P. Jorissen i inni, Rules for Naming Inorganic Compounds: Report of the Committee of the International Union of Chemistry for the Reform of Inorganic Chemical Nomenclature, 1940, „Journal of the American Chemical Society”, 63 (4), 1941, s. 889–897, DOI: 10.1021/ja01849a001.
- ↑ a b H. Bassett i inni, Nomenclature of Inorganic Chemistry, „Journal of the American Chemical Society”, 82 (21), 1960, s. 5523–5544, DOI: 10.1021/ja01506a002.
- ↑ a b Nomenclature of Inorganic Chemistry: Second Edition – Definitive Rules 1970, „Pure and Applied Chemistry”, 28 (1), 1971, s. 1–110, DOI: 10.1351/pac197128010001 .
- ↑ G.J. Leigh, H.A. Favre, W.V. Metanomski, Principles of Chemical Nomenclature. A Guide to IUPAC Recommendations, Blackwell Science, 1998.
- ↑ Zofia Kluz, Michał M. Poźniczek, Nomenklatura związków chemicznych. Poradnik dla nauczycieli, Wrocław: Wydawnictwo Uniwersytetu Wrocławskiego (seria Wiadomości Chemiczne. Biblioteka), s. 17–18, ISBN 83-229-1948-4.
- ↑ Włodzimierz Trzebiatowski, Chemia nieorganiczna, wyd. 8, Warszawa: Państwowe Wydawnictwo Naukowe, 1978, s. 265–267.
Bibliografia
- Neil G. Connelly i inni, Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005 (Red Book), International Union of Pure and Applied Chemistry, RSC Publishing, 2005, ISBN 978-0-85404-438-2 (ang.).