Reakcja Michaela
W tym artykule zbadamy wpływ Reakcja Michaela na różne aspekty życia codziennego. Od wpływu na gospodarkę po znaczenie w sferze kulturalnej, Reakcja Michaela pozostawił znaczący ślad we współczesnym społeczeństwie. Poprzez dogłębną analizę sprawdzimy, jak Reakcja Michaela ukształtował dynamikę społeczną i stworzył nowe możliwości i wyzwania. Od momentu pojawienia się Reakcja Michaela wzbudził duże zainteresowanie i wywołał pełne pasji debaty, co sprawiło, że zrozumienie jego wagi i znaczenia w dzisiejszym świecie stało się kluczowe. Patrząc całościowo, artykuł ten stara się rzucić światło na różne aspekty Reakcja Michaela i jego wpływ na różne sfery ludzkiego życia.
Reakcja Michaela – reakcja chemiczna, której kluczowym etapem jest addycja nukleofilowa karboanionu do α,β-nienasyconych związków karbonylowych. Jest katalizowana zasadowo. Reakcja Michaela prowadzi do utworzenia nowego wiązania węgiel-węgiel, można ją stosować do wielu różnorodnych substratów, często wymaga jednak bezwodnego środowiska.
Mechanizm
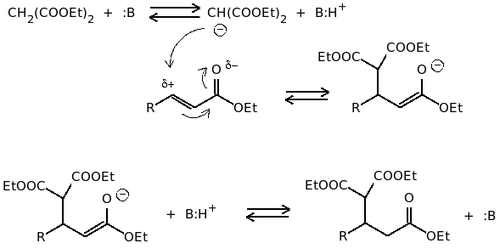
Pierwszym etapem jest utworzenie karboanionu w wyniku ataku zasady na związek z aktywną grupą metylenową, w wyniku czego następuje oderwanie protonu i powstanie karboanionu. Związki, z których powstaje karboanion, muszą posiadać właściwości kwasowe (tzw. C-H kwasy). Wspomniana grupa metylenowa powinna być połączona z jedną lub dwiema grupami wyciągającymi elektrony (EWG - Electron Withdrawing Group). W związkach tego typu ładunek ujemny jest zdelokalizowany i stabilizowany rezonansowo przez grupę (grupy) EWG. Można to przedstawić na przykładzie malonianu dietylu. Analogicznie zachowują się np. acetylooctan etylu czy acetyloaceton.

W drugim etapie powstały uprzednio karboanion o cechach silnego, ale miękkiego nukleofila przyłącza się do związku α,β-nienasyconego.
W trzecim etapie następuje utworzenie końcowego produktu wraz z regeneracją katalizatora.
Zastosowanie
Zastosowanie reakcji Michaela w syntezie organicznej jest bardzo szerokie, gdyż prowadzi ona do powstania nowego wiązania węgiel-węgiel. Spektrum reagentów jest tu dość szerokie.
Jako związek α,β-nienasycony można zastosować na przykład (estry etylowe lub inne):
- cynamonian etylu
- krotonian etylu
- fumaran etylu
- 2-oksocykloheksen
- keton metylowo-winylowy
- nitrostyren
- akrylonitryl
Jeszcze większa jest możliwość zastosowania prekursorów karboanionów, dla przykładu:
- malonian dietylu
- fenylooctan etylu
- nitrometan, nitroetan
- malononitryl, cyjanooctan etylu
- acetyloaceton
- acetylooctan etylu
Jako pewnego rodzaju utrudnienie można uważać stosowany katalizator. Jako zasadę stosuje się bowiem etanolan sodu, który rozkłada się pod wpływem nawet śladowych ilości wody, co pociąga za sobą konieczność stosowania bezwodnych rozpuszczalników i świeżo destylowanych substratów. Niektóre reakcje typu Michaela mogą być katalizowane aminą.
Asymetryczna reakcja Michaela
Jeśli w produkcie tworzy się nowe centrum stereogeniczne, a reakcję Michaela prowadzi się w obecności katalizatora chiralnego, może ona mieć przebieg stereoselektywny, tj. prowadzić to powstania głównie jednego enancjomeru produktu[1]. W reakcji Michaela zwykle stosuje się w tym celu katalizatory oddziałowujące przez wiązania wodorowe, takie jak chiralne tiomoczniki[1][2] lub amidy kwasu kwadratowego[1][3]. Przykładem asymetrycznej reakcji Michaela jest addycja nitrometanu do aldehydu trans-cynamonowego lub malonianu dietylu do β-nitrostyrenu w obecności chiralnych amidów kwasu kwadratowego. Nadmiar enencjomeryczny w tych reakcjach wyniósł 86–92%. Uzyskane chiralne produkty pośrednie zostały przekształcone stereospecyficznie w baklofen[1].
Reakcja aza-Michaela
Wariantem reakcji Michaela, jest reakcja addycji amin do związków nienasyconych zawierających EWG w pozycji α. Reakcja ta nosi nazwę reakcji aza-Michaela i prowadzi do wytworzenia wiązania węgiel-azot (alkilowanie aminy). W przeciwieństwie do klasycznej reakcji Michaela, wersja "aza" nie wymaga katalizatora zasadowego i często może być prowadzona w wodzie lub alkoholu. Jako katalizatory stosowane mogą być np. SiCl4, azotan cerowo-amonowy (CAN), Cu0[4] lub kwas borowy[5]:
Reakcja tio-Michaela
Innym wariantem reakcji Michaela, jest reakcja addycji tioli do związków nienasyconych zawierających EWG w pozycji α. Reakcja ta nosi nazwę reakcji tio-Michaela i prowadzi do wytworzenia wiązania węgiel-siarka. W reakcji stosuje się różne układy katalizator/rozpuszczalnik, np: InBr3/DCM, RuCl3/PEG, Bi(NO)3/DCM, Bu4NBr, HCl/woda czy NaHCO3/woda. Katalizatorem mogą być również aminy, a w szczególności aminokwasy, np. L-prolina[6]:
Opisano również reakcje tio-Michaela katalizowaną kwasem borowym[7]:
Przypisy
- ↑ a b c d Eva Veverková i inni, Squaramide-Catalyzed Michael Addition as a Key Step for the Direct Synthesis of GABAergic Drugs, „Synthesis”, 48 (10), 2016, s. 1474–1482, DOI: 10.1055/s-0035-1560420, ISSN 0039-7881 (ang.).
- ↑ Tomotaka Okino, Yasutaka Hoashi, Yoshiji Takemoto, Enantioselective Michael Reaction of Malonates to Nitroolefins Catalyzed by Bifunctional Organocatalysts, „Journal of the American Chemical Society”, 125 (42), 2003, s. 12672–12673, DOI: 10.1021/ja036972z (ang.).
- ↑ Jeremiah P. Malerich, Koji Hagihara, Viresh H. Rawal, Chiral Squaramide Derivatives are Excellent Hydrogen Bond Donor Catalysts, „Journal of the American Chemical Society”, 130 (44), 2008, s. 14416–14417, DOI: 10.1021/ja805693p, PMID: 18847268, PMCID: PMC2701638 (ang.).
- ↑ Michael Addition. Organic Chemistry Portal. . (ang.).
- ↑ Mihir K. Chaudhuri i inni, Boric acid: a novel and safe catalyst for aza-Michael reactions in water, „Tetrahedron Letters”, 46 (48), 2005, s. 8329–8331, DOI: 10.1016/j.tetlet.2005.09.167 (ang.).
- ↑ Atul Kumar, Akanksha, Amino acid catalyzed thio-Michael addition reactions, „Tetrahedron”, 63 (45), 2007, s. 11086–11092, DOI: 10.1016/j.tet.2007.08.033 (ang.).
- ↑ Mihir K. Chaudhuri, Sahid Hussain, Boric acid catalyzed thia-Michael reactions in water or alcohols, „Journal of Molecular Catalysis A: Chemical”, 269 (1-2), 2007, s. 214–217, DOI: 10.1016/j.molcata.2007.01.014 (ang.).


