Kwas barbiturowy
Kwas barbiturowy to temat, który z biegiem czasu wzbudził zainteresowanie wielu osób. Jego znaczenie przejawia się w różnych aspektach życia codziennego, od kultury popularnej po politykę i ekonomię. Badając jego implikacje, odkrywamy wszechświat możliwości, który rozbudza naszą ciekawość i zaprasza do refleksji nad ludzką naturą. W tym artykule zagłębimy się w głębiny Kwas barbiturowy, badając jego pochodzenie, wpływ i ewolucję na przestrzeni historii. Poprzez szczegółową analizę będziemy starali się lepiej zrozumieć to zjawisko i jego wpływ na współczesny świat.
| |||||||||||||||||||||||||||
 tautomeria kwasu barbiturowego | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||
| Wzór sumaryczny |
C4H4N2O3 | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
H2C(CO)2(NH)2CO | ||||||||||||||||||||||||||
| Masa molowa |
128,09 g/mol | ||||||||||||||||||||||||||
| Wygląd | |||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||
Kwas barbiturowy (malonylomocznik) – organiczny związek chemiczny, heterocykliczny amid występujący w kilku formach tautomerycznych[1].
Został odkryty w roku 1863 przez Adolfa von Baeyera[potrzebny przypis].
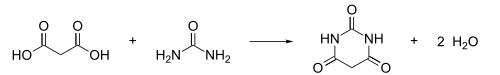
Jest otrzymywany w reakcji mocznika z kwasem malonowym[1]:
C-alkilopochodne kwasu barbiturowego nazywane są barbituranami. Stosuje się je jako środki nasenne.
Przypisy
- ↑ a b c d Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 209, ISBN 83-7183-240-0.
- ↑ a b Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.